ژن درمانی در موکوپلی نوع 7
موکوپلی ساکاریدوز VII یک بیماری نادر است که ذخیره سازی ژنتیکی لیزوزوم را در بدن مختل می کند و با تجمع گلیکوز امینو گلیکان ها در بافت همبند تشخیص داده می شود، این تجمع منجر به درگیری پیشرونده چند سیستمی با شدتی از خفیف تا شدید می گردد. درمان هایی که تا چندی پیش برای MPS VII ارائه شده بود شامل رفع علائم اسکلتی با ارتوپدی و کنترل نشانه های بیماری از طریق پیوند مغز استخوان است اما با پیشرفت چشمگیر علم ژنتیک و مهندسی ژن ها متد درمانی دیگری برای این بیماری در نظر گرفته شده است که دانشمندان به آن بسیار امیدوار هستند. ژن درمانی در موکوپلی ساکاریدوز VII راهکار هوشمندانه ای است که توجه تمام مبتلایان و پزشکان فعال در درمان این بیماری را به خود منعطف نموده است و گزارشات اخیر خبرهای خوشایندی را از نتیجه آن منتشر نموده اند. مرکز آزمایشگاهی سیتوژنوم در این مقاله اطلاعاتی را از آخرین موفقیت ها درباره ژن درمانی موکوپلی نوع 7 در اختیارتان قرار خواهد داد.
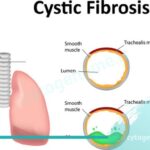
موکوپلی ساکاریدوز نوع 7 چیست و چه ژنی در آن جهش می یابد؟
سندروم اسلای (Sly Syndrome) یا موکوپلی ساکاریدوز نوع 7 (MPS VII) یک بیماری نادر و پیشرونده ژنتیکی متابولیسمی است که طی آن بدن آنزیم لازم برای شکستن زنجیره های طولانی مولکول های قند را ندارد یا مقدار آن کم است. این زنجیره های مولکولی گلیکوز آمینو گلیکان نامیده می شوند (البته قبلاً موکوپلی ساکاریدها نامیده می شدند)، با تجمع این مولکول ها در بدن بسیاری از اندام ها و بافت ها تحت تأثیر قرار می گیرند. MPS VII ناشی از تغییرات (جهش) در ژن GUSB است که منجر به کمبود آنزیم بتا گلوکورونیداز می شود. انواع جهش های مختلف در این ژن می تواند طیف گسترده ای از علائم و یافته های فیزیکی را در بر داشته باشد. ویژگی های بالینی MPS VII از بیماری به بیمار دیگر متفاوت است، اما همه مبتلایان عقب ماندگی رشد، ناهنجاری های اسکلتی، تغییرات قابل مشاهده استخوانی در اشعه ایکس (dysostosis multiplex)، درجاتی از ناتوانی ذهنی و قد کوتاهی دارند. MPS VII به عنوان یک بیماری ژنتیکی با طرح توارث اتوزومال مغلوب (AR) به ارث می رسد و در ازدواج های فامیلی بیشتر دیده می شود. به طور کلی اگر پدر و مادر هر دو حامل یک نسخه غیرفعال از ژن مربوط به این بیماری باشند، هر یک از فرزندانشان 25 درصد (1 از 4) احتمال ابتلا به این بیماری را دارند.
ژن درمانی در موکوپلی ساکاریدوز VII
ژن درمانی بیماری موکوپلی ساکریدوزیس نوع 7 به چند روش می تواند انجام بگیرد که در ادامه به آن ها اشاره می کنیم:
- رایج ترین شکل ژن درمانی در موکوپلی ساکاریدوز VII اینطور است که ژنی که یک پروتئین عملکردی را کد می کند از طریق یک “انتقال دهنده” که وکتور (Vector) نامیده می شود را به فرد مبتلا انتقال می دهند و باعث می شوند پروتئینی که مقدار آن در بدن کم بوده است مجددا شروع به تولید شود. در واقع علاوه بر باقی ماندن ژن معیوب در سلول ها، یک نسخه از ژن سالم GUBS نیز وارد بدن می شود و کم کاری ژن جهش یافته را جبران می نماید.
- ژن درمانی in vivo شامل تزریق سیستمیک وکتور به ورید محیطی، شریان یا ورید پورتال یا تزریق موضعی به اندام خاصی مانند مغز یا ماهیچه است.
- ژن درمانی ex vivo اینگونه است که ابتدا از طریق شیمی درمانی به حذف سلول هایی مانند سلول های بنیادی خون ساز پرداخته می شود. به طور همزمان در شرایط آزمایشگاهی سلول های بنیادی خود فرد یا بستگان درجه 1 او که حاوی ژن سالم است اصلاح می شود و در نهایت سلول های اصلاح شده به بیمار تزریق می شود تا علائم او را از بین ببرند.
وکتورهای مورد استفاده برای ژن درمانی MPS VII کدامند؟
برای ژن درمانی در موکوپلی ساکاریدوز VII بیشتر از ناقل های ویروسی از جنس آدنوویروس ها، ویروس های مرتبط با آدنو (AAV)، رتروویروس ها و یا ویروس هرپس سیمپلکس (HSV) استفاده می شود. قدرت بیماری زایی این ویروس ها در شرایط آزمایشگاهی از بین برده می شود و آماده می شوند تا قسمتی از یک ژن یا تمام آن را به قسمت خاصی از بدن یک فرد بیمار منتقل کنند.
آیا ژن درمانی در موکوپلی نوع 7 موثر است؟
خبر مسرت بخش این است که نتایج حاصل از ژن درمانی در موکوپلی ساکاریدوز VII بسیار امیدوار کننده بوده است. پس از اینکه ژن مورد نظر وارد بدن می شود شروع به تولید آنزیم های مخصوص برای از بین بردن گلیکوز آمیوند گلیکان ها (GAGs) می نماید؛ این آنزیم ها از طریق جریان خون به اندام هایی می روند که تحت تاثیر تجمع GAGs قرار گرفته اند. نتایج زیر حاصل چندین سال فعالیت ژنتیک دانان و تلاششان برای درمان MPS VII می باشد:
- پس از ورود ژن جدید به بدن بسیاری از اندام ها مانند کبد، طحال و ریه به راحتی اصلاح می شوند.
- اصلاح آئورت، استخوان، غضروف، چشم و مغز دشوارتر است. این مورد می تواند ناشی از آن باشد که انتشار آنزیم در این مناطق ناکافی است یا بیان M6PR کم باشد.
- اگر مقدار تزریق شده ژن به اندازه کافی بالا باشد، برخی از آنزیم های مورد نظر می توانند از سد خونی مغزی عبور کنند و آسیب های مغزی بیمار را تا حد قابل قبولی مرتفع کنند. همچنین اگر تزریق در مناطق خاصی از مغز صورت بگیرد، نتایج می توانند چشمگیر باشند. این شامل تزریق به جسم مخطط (استریاتوم)، بطن جانبی، تالاموس، قشر مغز، هیپوکامپ یا مایع مغزی نخاعی است. به این ترتیب ضایعات پاتولوژیک در مغز را کاهش یافته و یا عملکرد عصبی بهبود بخشیده خواهد شد.
نویسنده و مترجم: دکتر سارا فرخی مشاور ژنتیک