هیپرکلسترولمی خانوادگی (Familial hypercholesterolemia) مرتبط با گیرنده لیپوپروتئین با چگالی کم (LDLR) شایع ترین اختلال مندلی است که تا به امروز هیچ درمان قطعی و موثری برایش ارائه نشده است. اخیراً چندین روش درمانی جدید برای کاهش میزان LDL در بیماران فوق الذکر که هموزیگوت و هتروزیگوت هستند ارائه شده است. یکی از این راهکارهای پیشنهادی ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم بوده است که طی کارازمایی های زیادی مورد بررسی قرار گرفته است. نتایج بیشتر کارازمایی ها نشان می دهد که متدهایشان نیاز به تجویز مکرر و مادام العمر دارد که ظاهرا مشابه دارو درمانی های معمولی است. اما مزیت مداخله از طریق ژن درمانی نسبت به سایر درمان ها، پتانسیل اصلاح مادام العمر فعالیت بدن در تنظیم مقدار LDL است که ژن مورد نظر را از طریق یک ناقل وارد بدن می نماید. هدف اصلی این متد، مدیریت بالینی و کنترل کلسترول خون به منظور کاهش خطر تصلب شرایین و جلوگیری از بیماری های مرتبط می باشد.
جهش ژنتیکی و هایپر کلسترولمی خانوادگی
هایپرکلسترولمی فامیلی (FH) یک اختلال اتوزومال غالب ناشی از جهش در ژن گیرنده LDL است که به آن اختصارا LDLR نیز می گویند. افزایش میزان کلسترول خون (هایپرکلسترولمی) مشخصه FH است و مبتلایان FH هموزیگوت در اثر بیماری ایسکمیک قلبی ثانویه به آترواسکلروز شدید مبتلا شده و در سنین پایین می میرند. دارو درمانی های موجود برای افزایش میزان کلسترول بد یا همان LDL خون پیشرفت چشمگیری را نشان نداده و به جز کنترل علائم موقتی، باقی اهداف درمانی با شکست رو به رو شده اند. به این ترتیب فقدان یک درمان موثر برای FH باعث کاوش برای یافتن درمانی مناسب به عنوان یک رویکرد جایگزین برای مدیریت این بیماری ویرانگر شد. نتیجه تلاش های مستمر پزشکان ژنتیک موفقیت در ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم شد که در ادامه به بررسی آن می پردازیم.
فعالیت طبیعی ژن LDLR
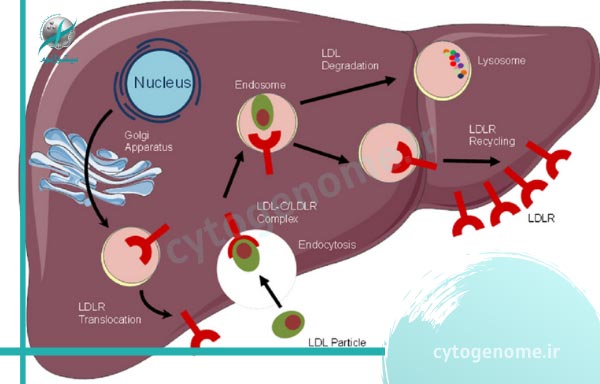
ژن LDLR دستورالعمل هایی را برای ساخت پروتئینی به نام “گیرنده لیپوپروتئین با چگالی کم” ارائه می دهد. این گیرنده به ذراتی به نام لیپوپروتئین های با چگالی کم (LDL) که حامل اصلی کلسترول در خون هستند، متصل می شود. کلسترول یک ماده مومی شکل و چربی مانند است که در بدن تولید می شود و از مصرف غذاهای حیوانی به دست می آید. گیرنده های لیپوپروتئین با چگالی کم در سطح خارجی بسیاری از انواع سلول ها قرار دارند؛ پس از ورود به سلول LDL تجزیه می شود تا کلسترول خود را آزاد کند و سپس این کلسترول توسط سلول استفاده می شود، ذخیره می شود یا از بدن خارج می گردد. پس از اینکه گیرنده های لیپوپروتئین با چگالی پایین محموله خود را رها کردند، به سطح سلول بازگردانده می شوند تا LDL های بیشتری را جذب کنند. به همین دلیل است که گیرنده های لیپوپروتئین با چگالی کم نقش مهمی در تنظیم میزان کلسترول خون دارند. آن ها به ویژه در کبد (اندام مسئول حذف کلسترول اضافی از بدن)، فراوان هستند. تعداد گیرنده های لیپوپروتئین با چگالی کم در سطح سلول های کبد تعیین می کند که کلسترول با چه سرعتی از جریان خون حذف شود. حال تصور کنید که این ژن ها در بدن به صورت ژنتیکی معیوب باشد! اینجاست که اهمیت ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم مشخص می شود.
استفاده از ویروس برای ژن درمانی گیرنده LDL
اولین کارآزمایی بالینی ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم تقریباً 18 سال پیش انجام شد و طی آن از ویروس ها به منظور رسیدن به هدف مورد نظر استفاده شد. ویروس ها با توجه به توانایی هایی که دارند، برای انتقال ژن سالم به بدن فرد بیمار به عنوان یک انتقال دهنده عمل می کنند و اصطلاحا به آن ها “ناقل” یا “وکتور” می گویند. ناقل های ژن درمانی مبتنی بر ویروس های اصلاح شده بدون شک موثرترین سیستم های انتقال ژن هستند که امروزه با اهداف پزشکی مورد استفاده قرار می گیرند. با این حال اثربخشی آن ها در انتقال ژن به دلیل سمیت و بیماری زایی شدیدشان کاهش می یابد. یک ناقل ایده آل برای ژن درمانی انسانی باید سطوح درمانی پایداری را برای بیان ژن (روشن کردن ژن و تولید محصولات مورد نیاز) داشته باشد. این ناقل باید بدون به خطر انداختن زندگی میزبان (در سطح سلولی یا جسمی) ماموریت خود را به پایان برساند. ناقل های غیر ویروسی به دلیل سمیت کمی، تولید ژن نسبتا آسان و تطبیق پذیری زیاد جایگزین های جذابی برای سیستم های انتقال ژن ویروسی هستند. با این حال طی پیشرفت های چشمگیر در علم مهندسی ژنتیک، ناقل های جدید که از ویروس ها و لنتی ویروس های مرتبط با آدنو مشتق شده اند، اکنون با عملکردی خوب در دسترس هستند و تحقیقات در مورد تعیین ایمنی و کارایی آن ها به منظور آماده سازی برای کاربرد بالینی برای انواع بیماری ها در حال انجام است. تصحیح دائمی فنوتیپ با تجویز منفرد یک ناقل ژن، هدفی است که باید به آن دست یافت.
ژن درمانی برای گیرنده لیپوپروتئین با چگالی کم
برای ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم در انسان، لازم است که آزمایشات اولیه بر روی حیواناتی انجام شود که بیشترین شباهت ژنتیکی را با انسان دارد. همسانی بین گیرنده LDL (یا LDLR) انسان و موش بسیار زیاد است و به همین دلیل دانشمندان مدل حیوانی “موش” را برای تحقیقات خود انتخاب نمودند. اولین کارآزمایی بالینی روی ژن درمانی LDLR برای درمان FH شامل یک رویکرد ex vivo با استفاده از انتقال ژن با واسطه رتروویروس بود و نشان داد که انتقال ژن با واسطه ویروس های شبه آدنو (AAV) منجر به ظهور آنتی بادی های ضد LDLR شد. موش ها قبل از شروع ژن درمانی به مدت 20 هفته با رژیم غذایی حاوی کلسترول بالا تغذیه شدند و احتمال بروز بیماری هایی همچون مشکلات قلبی و آترواسکلروز در آن ها افزایش یافت. سپس آن ها ژن درمانی برای آن ها با یک تزریق داخل وریدی HD-Ad-LDLR شروع شد. در گزارشات نتیجه ای مشاهده شد که سطح کلسترول پلاسمایی در گروهی از موش ها که با دوز بالایی تحت درمان قرار گرفته اند به طور قابل توجهی نسبت به قبل از درمان کاهش یافته است. دیگریافته های علمی نیز با مطالعات اخیر مطابقت داشته و پژوهشگران نشان داده اند که این متد در آینده ای نزدیک می تواند در اختیار بیماران سراسر دنیا قرار بگیرد.
کلام آخر
ژن درمانی در ناهنجاری های گیرنده لیپوپروتئین با چگالی کم مزایای بالقوه ای را برای سایر ناقل های موجود در حال حاضر برای درمان FH هموزیگوت ارائه می دهد. اهداف درمانی آینده باید بر ایمن تر کردن ناقل های انتقال ژن همراه با بهبود نتایج حاصله باشد. درست است که این راهکار هنوز در سطح آزمایشگاهی و پژوهشی در حال انجام است اما پژوهشگران امیدوارند که طی چند سال آینده بتوانند نتیجه تلاش و علم خود را در اختیار مراکز درمانی مختلف در سطح جهان بگذارند تا بیماران را از خطر عوارض جدی تهدید کننده زندگی نجات دهند.
نویسنده و مترجم: دکتر سارا فرخی مشاور ژنتیک