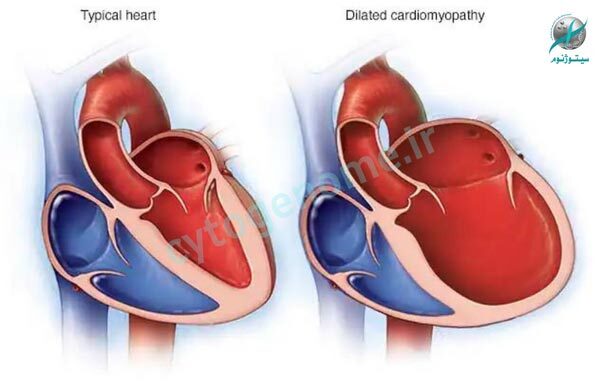
کاردیومیوپاتی هیپرتروفیک (HCM) یک بیماری ژنتیکی است که باعث ضخیم شدن یا هیپرتروفی عضله قلب می شود. سلولهای قلب در HCM غیرطبیعی هستند و در یک الگوی نامرتب چیده شده اند علاوه بر این، دریچه میترال ممکن است تحت تأثیر قرار گیرد که در برخی از بیماران ممکن است برای مدت کوتاهی جریان خون را از محفظه پمپاژ اصلی قلب مسدود کند، که می تواند منجر به برگشت خون به دهلیز چپ و فشار بیشتر از حد طبیعی در قلب شود. پزشکان تا الان هیچ راهکار قطعی را برای درمان کاردیومیوپاتی هیپرتروفیک (HCM) پیدا نکرده اند. با این حال، چندین روش درمانی برای تسکین یا از بین بردن علائم و ایجاد محافظت در برابر مرگ ناگهانی در دسترس قرار دارد که اکثریت قریب به اتفاق بیماران HCM از این فرصت برای دستیابی به طول عمر طبیعی با کیفیت عالی استفاده می کنند. با این مقاله از سیتوژنوم همراه باشید تا اطلاعات بیشتری در مورد درمان های موجود کسب نمایید.
آیا لازم است کاردیومیوپاتی هیپرتروفیک را درمان کرد؟
درمان کاردیومیوپاتی هیپرتروفیک به وضعیت فردی مبتلا بستگی دارد. لازم به ذکر است که اکثر افراد مبتلا به HCM طول عمر طبیعی دارند و علائمی ندارند یا آنقدر علائمشان مشکل زا نیست که نیازی به درمان داشته باشد. با این حال ممکن است موارد زیر نیاز به درمان داشته باشند:
- کاهش علائم نارسایی قلبی، خستگی، ضربان قلب قوی (تپش قلب) و درد قفسه سینه
- خارج کردن عضله اضافی سپتوم بین بطنی برای بهبود جریان خون از قلب و کاهش فشار در قلب
- درمان ریتم غیر طبیعی قلب و یا کاهش خطر مرگ ناگهانی
درمان کاردیومیوپاتی هیپرتروفیک چگونه امکانپذیر است؟
اهداف درمان کاردیومیوپاتی هیپرتروفیک تسکین علائم و جلوگیری از مرگ ناگهانی قلبی در افراد در معرض خطر است. البته ناگفته نماند که نوع درمان بستگی به شدت علائم دارد؛ به این ترتیب بیمار و پزشکش در مورد مناسب ترین راهکار درمانی تبادل نظر خواهند کرد. درمان های موجود به شرح زیر می باشند:
الف) دارو درمانی
برخی داروها می توانند به کاهش فشار شدید در عضله قلب و کاهش ضربان قلب کمک کنند تا قلب بتواند خون را بهتر پمپاژ کند. داروهای درمان کاردیومیوپاتی هیپرتروفیک و علائم آن ممکن است شامل موارد زیر باشد:
- مسدود کننده های بتا مانند متوپرولول (Lopressor، Toprol-XL)، پروپرانولول (Inderal، Innopran XL) یا آتنولول (Tenormin)
- مسدود کننده های کانال کلسیم مانند وراپامیل (ورلان، کالان SR،) یا دیلتیازم (کاردیزم، تیازاک)
- داروهای ضربان قلب مانند آمیودارون (پاسرون) یا دیسوپیرامید (Norpace)
- رقیق کننده های خون مانند وارفارین (جانتوون)، دابیگاتران (پراداکسا)، ریواروکسابان (Xarelto) یا آپیکسابان (Eliquis) برای جلوگیری از لخته شدن خون در صورت داشتن فیبریلاسیون دهلیزی یا نوع آپیکال کاردیومیوپاتی هیپرتروفیک(که می تواند خطر مرگ ناگهانی قلبی را افزایش دهد)
ب) عمل جراحی
چندین عمل جراحی یا روش برای درمان کاردیومیوپاتی یا علائم آن در دسترس است؛ آن ها عبارت هستند از:
- میکتومی سپتال (Septal myectomy): اگر داروهای تجویزی پزشک متخصص علائم فرد را بهبود ندهند، ممکن است این جراحی که نوعی عمل قلب باز است توصیه شود. این عمل جراحی شامل برداشتن بخشی از دیواره ضخیم شده و بیش از حد رشد کرده (سپتوم) بین حفره های قلب است. میکتومی سپتال به بهبود جریان خون از قلب کمک می کند و جریان برگشتی خون را از طریق دریچه میترال کاهش می دهد (نارسایی میترال). جراحی میکتومی علائم را در بیش از 90 درصد از بیماران با خطر جراحی بسیار کم از بین می برد یا بهبود می بخشد و زمانی که توسط یک جراح مجرب انجام شود میزان عوارض پایین است (1 تا 2 درصد).
- میکتومی آپیکال (apical myectomy): بسته به محل ضخیم شدن عضله قلب، جراحی را می توان با استفاده از روش های مختلف انجام داد. در یک نوع جراحی به نام میکتومی آپیکال، جراحان عضله قلب ضخیم شده را برمی دارند. در تعداد کمی از بیماران در صورت وجود نارسایی قابل توجه دریچه میترال (نشت دریچه میترال)، ممکن است در زمان میکتومی نیاز به ترمیم (یا حتی در موارد غیر معمول تر، تعویض) دریچه میترال باشد.
- ابلیشن سپتال (Septal ablation): در این روش جراحان عضله ضخیم شده قلب را با الکل از بین می برند. الکل از طریق یک لوله بلند و نازک (کاتتر) به شریان خون رسانی به آن ناحیه تزریق می شود. این روش یک درمان غیرجراحی کاهش سپتوم است و با نام “درمان کاهش سپتوم غیر جراحی” (NSRT) نیز شناخته می شود. در این روش متخصص قلب یک کاتتر آنژیوپلاستی را وارد شریان کشاله ران می کند و آن را تا قاعده آئورت می کشد. کاتتر به داخل شریان کرونری چپ به شاخه ای که قسمت بالایی سپتوم را تامین می کند منتقل می شود و سپس مقدار کمی اتانول به این شاخه شریانی تزریق می گردد. اتانول باعث نوعی “حمله قلبی کنترل شده” می شود که منجر به مرگ بافت ماهیچه ای می شود. با گذشت زمان این آسیب منجر به نازک شدن قسمت بالایی تیغه قلبی می شود و انسداد جریان خون از بطن چپ را کاهش می دهد؛ این روش در 80 درصد موارد در کاهش انسداد جریان خون موفق خواهد بود. عوارض احتمالی این روش شامل اختلال در سیستم الکتریکی قلب (بلوک قلبی) است که نیاز به کاشت ضربان ساز دارد. ابلیشن الکلی فقط باید توسط یک متخصص قلب و عروق با تجربه در بیمارستانی انجام شود که تجربه مراقبت از افراد مبتلا به HCM را دارد. عوارض در افرادی که تحت عمل ابلیشن قرار می گیرند در مقایسه با میکتومی بیشتر است، تقریباً 10 درصد از افراد دچار بلوک کامل قلب می شوند که نیاز به ضربان ساز دارند و 10 درصد از بیمارانی که با روش اولیه به کاهش موفقیت آمیز انسداد دست نمی یابند.
- دفیبریلاتور قلبی قابل کاشت (ICD): ICD دستگاه کوچکی است که به طور مداوم ضربان قلب را کنترل می کند و مانند ضربان ساز در قفسه سینه کاشته می شود. اگر یک آریتمی شدید (تهدید کننده زندگی) در بدن فرد بیمار رخ دهد، ICD شوک های الکتریکی دقیق کالیبره شده را برای بازگرداندن ریتم قلب ارسال می کند. نشان داده شده است که استفاده از ICD به جلوگیری از مرگ ناگهانی قلبی، که در تعداد کمی از افراد مبتلا به کاردیومیوپاتی هیپرتروفیک رخ می دهد، کمک می کند.
- درمان انسداد مجرای خروجی بطن چپ: بخش قابل توجهی از بیماران HCM از انسداد مجرای خروجی بطن چپ (LVOTO) رنج می برند. بنابراین،بررسی انسداد با اکو در حال استراحت (با والسالوا) و اکو استرس در صورتی که گرادیان زیر 50 میلیمتر جیوه باشد باید انجام گیرد. درمان انسداد برای بیماران علامت دار (کلاس NYHA > II) اندیکاسیون دارد و درمان دارویی رویکرد خط اول خواهد بود.
کاردیومیوپاتی و بارداری
اگر کاردیومیوپاتی دارید و باردار هستید یا به بارداری فکر می کنید، ممکن است پزشکتان به شما توصیه کند که به یک پزشک با تجربه در مراقبت از زنان با حاملگی های پرخطر مانند پریناتولوژیست یا متخصص طب مادر و جنین مراجعه داشته باشید. زنان مبتلا به HCM به طور کلی می توانند با زایمان طبیعی واژینال در اکثر موارد بدون افزایش خطر عوارض جانبی زایمان کنند. قبل از باردار شدن، خانم باید با پزشک خود صحبت کند تا در مورد خطرات احتمالی، هرگونه تغییر دارویی که ممکن است مورد نیاز باشد و مراقبت های دوران بارداری صحبت کند. زنان مبتلا به HCM که باردار می شوند اغلب توسط یک پزشک متخصص زنان و پریناتولوژی تحت نظر قرار داشته باشند.
جمع بندی
در حال حاضر هیچ مداخله پزشکی وجود ندارد که سیر طبیعی HCM را تغییر دهد، اما مهارکننده های میوزین قلبی نوید درمان کاردیومیوپاتی هیپرتروفیک را می دهند. ژن درمانی با خاموش کردن ژن توسط فناوری ویرایش ژن CRISPR/Cas9 ممکن است روزی در پیشگیری از پیشرفت بیماری قبل از ظهور تظاهرات بالینی نقش داشته باشد. درمانهای کنونی بر علائم بیماری تمرکز می کنند، اما درمان های آینده نگر ممکن است امیدی را برای درمان مؤثر HCM روشن کند. تا آن زمان، شناخت نقش درمان های پزشکی، مداخله ای، دستگاهی و جراحی و استفاده از ترکیب آن ها با ورزش، برای بهبود کیفیت زندگی و بقای بیماران مبتلا به HCM ضروری است.
نویسنده و مترجم: دکتر سارا فرخی مشاور ژنتیک